为贯彻落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发〔2021〕16号),规范医疗器械信息系统建设与数据交换共享,国家药品监督管理局信息中心组织编制了《医疗器械注册与备案管理基本数据集》《体外诊断试剂注册与备案管理基本数据集》《医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)》《医疗器械(含体外诊断试剂)监管信息基础数据元值域代码(注册和备案部分)》4个标准的征求意见稿(见附1-4)。
现向社会公开征求意见。请填写标准征求意见反馈表(见附5),于2022年7月30日前以电子邮件形式反馈国家药监局信息中心。
电子邮箱:zhouhy@nmpaic.org.cn
1. 医疗器械注册与备案管理基本数据集(征求意见稿)
2.体外诊断试剂注册与备案管理基本数据集(征求意见稿)
3.医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)(征求意见稿)
4.医疗器械(含体外诊断试剂)监管信息基础数据元值域代码(注册和备案部分)(征求意见稿)
国家药监局信息中心
2022年7月1日
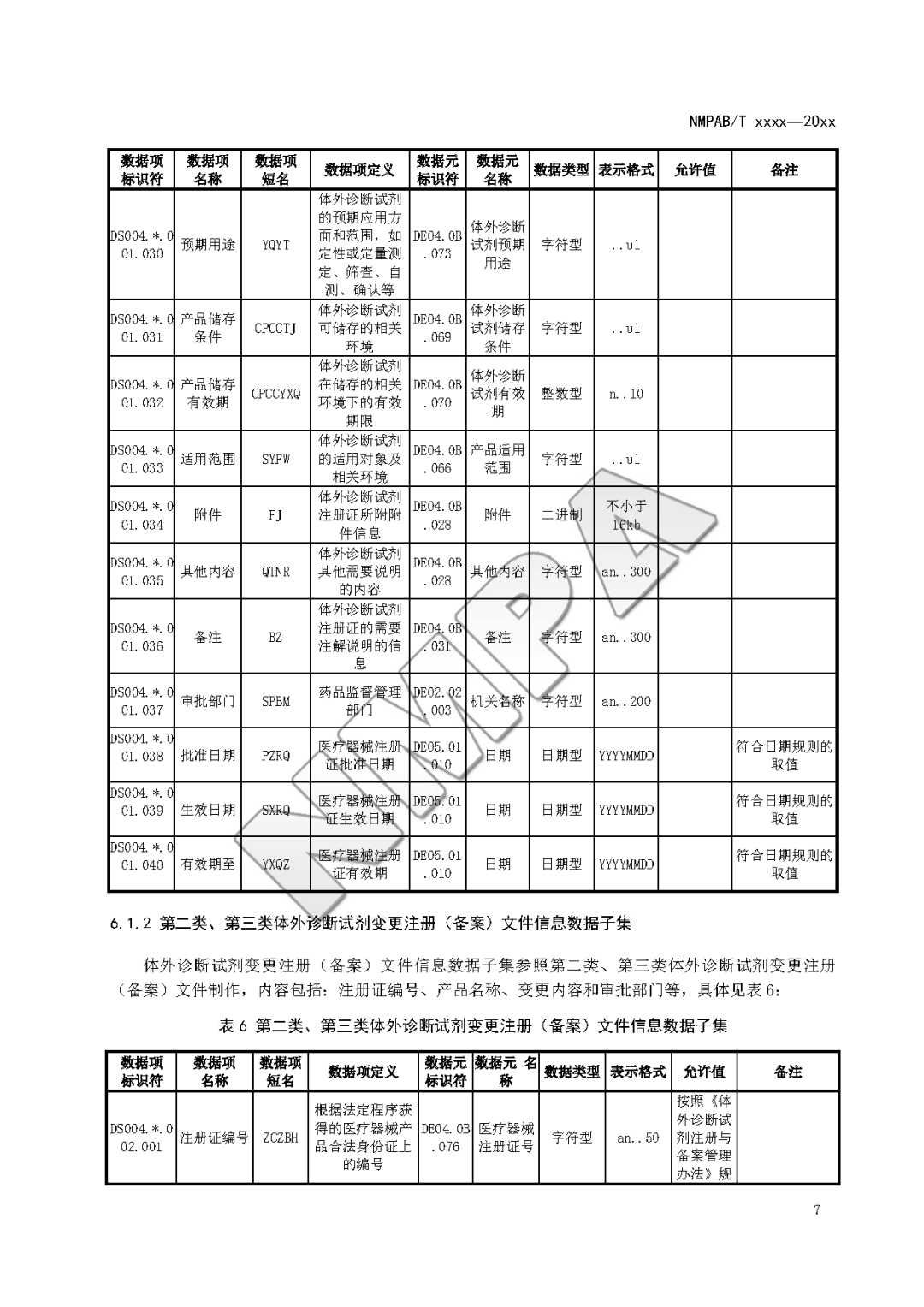
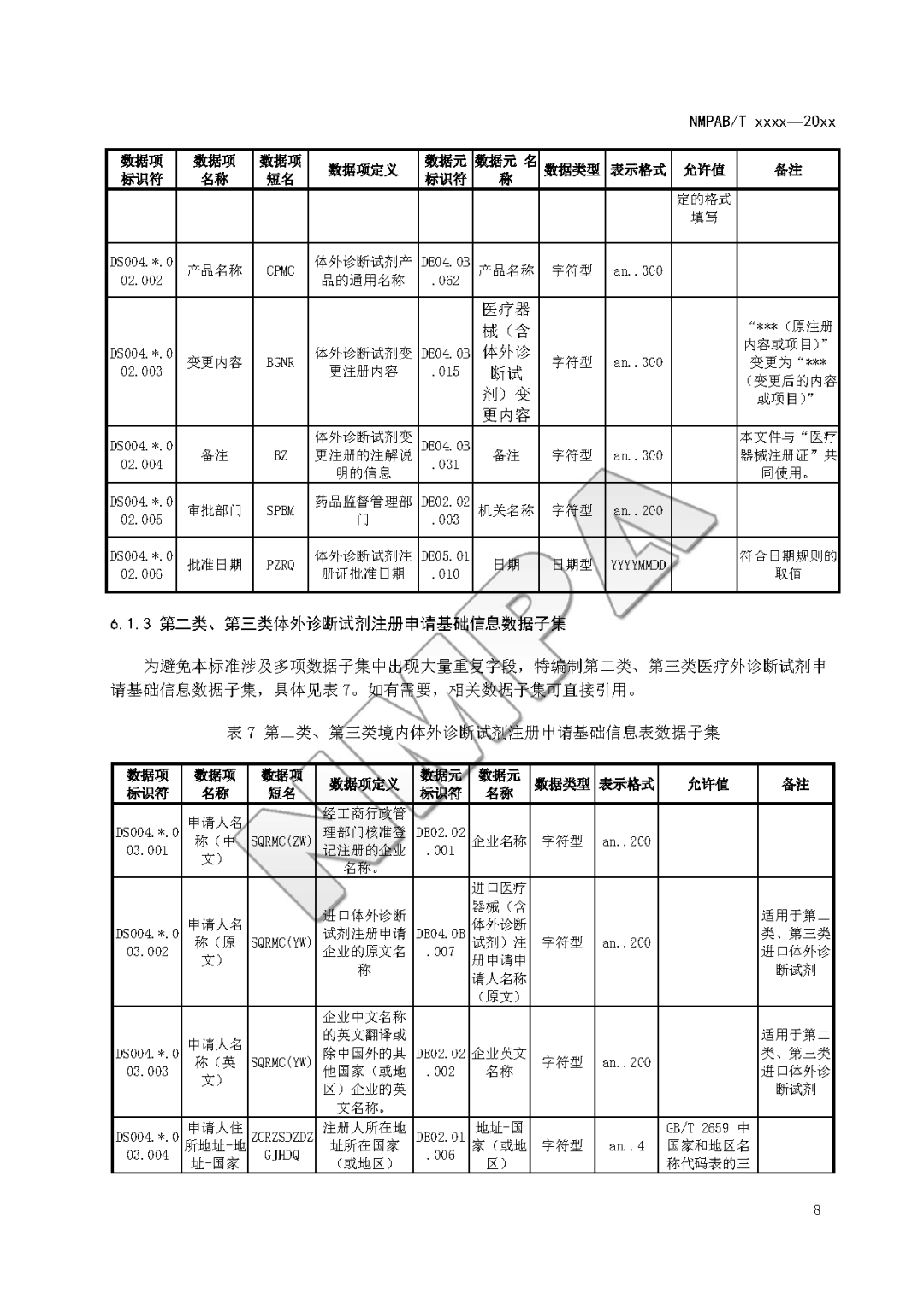
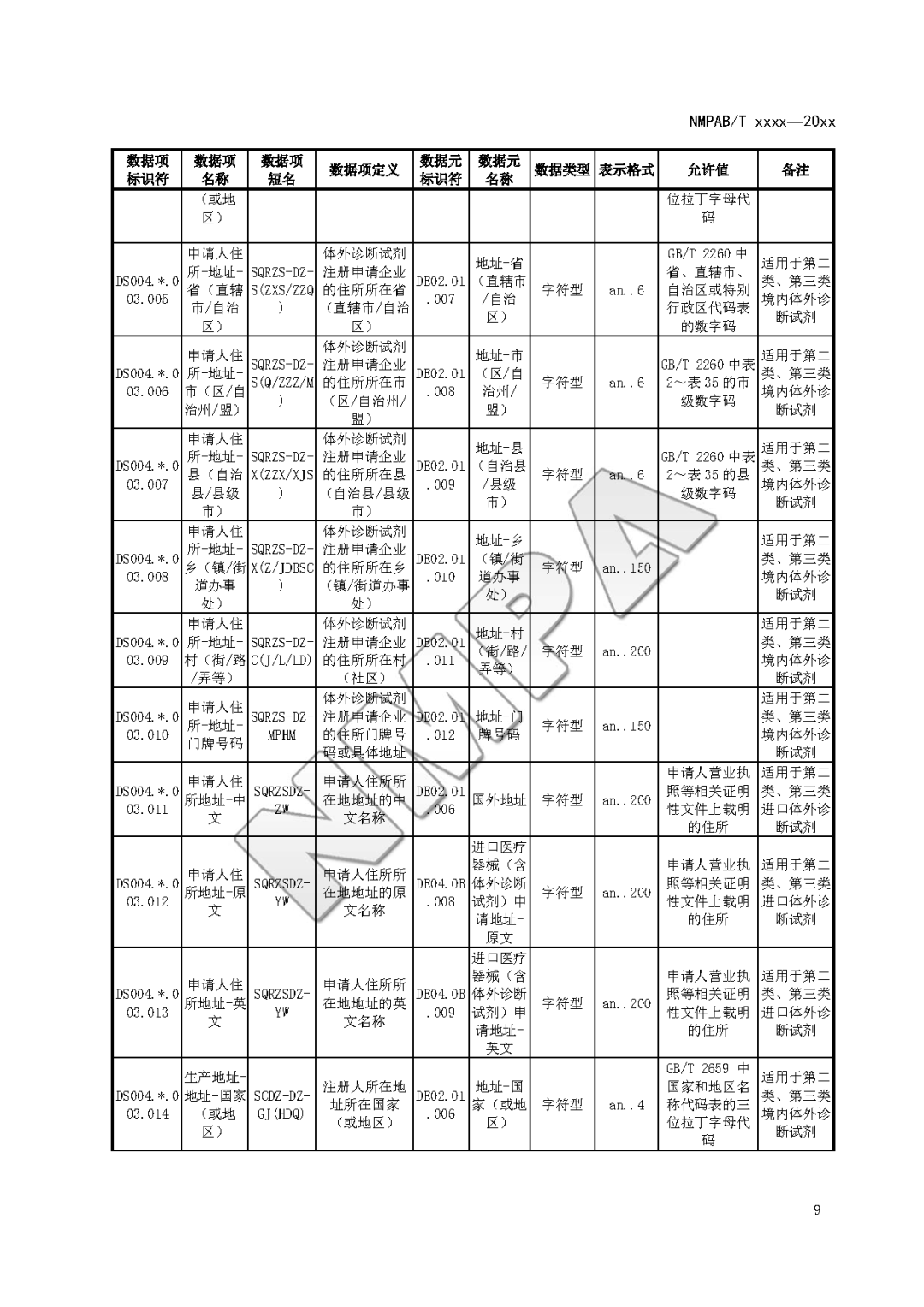
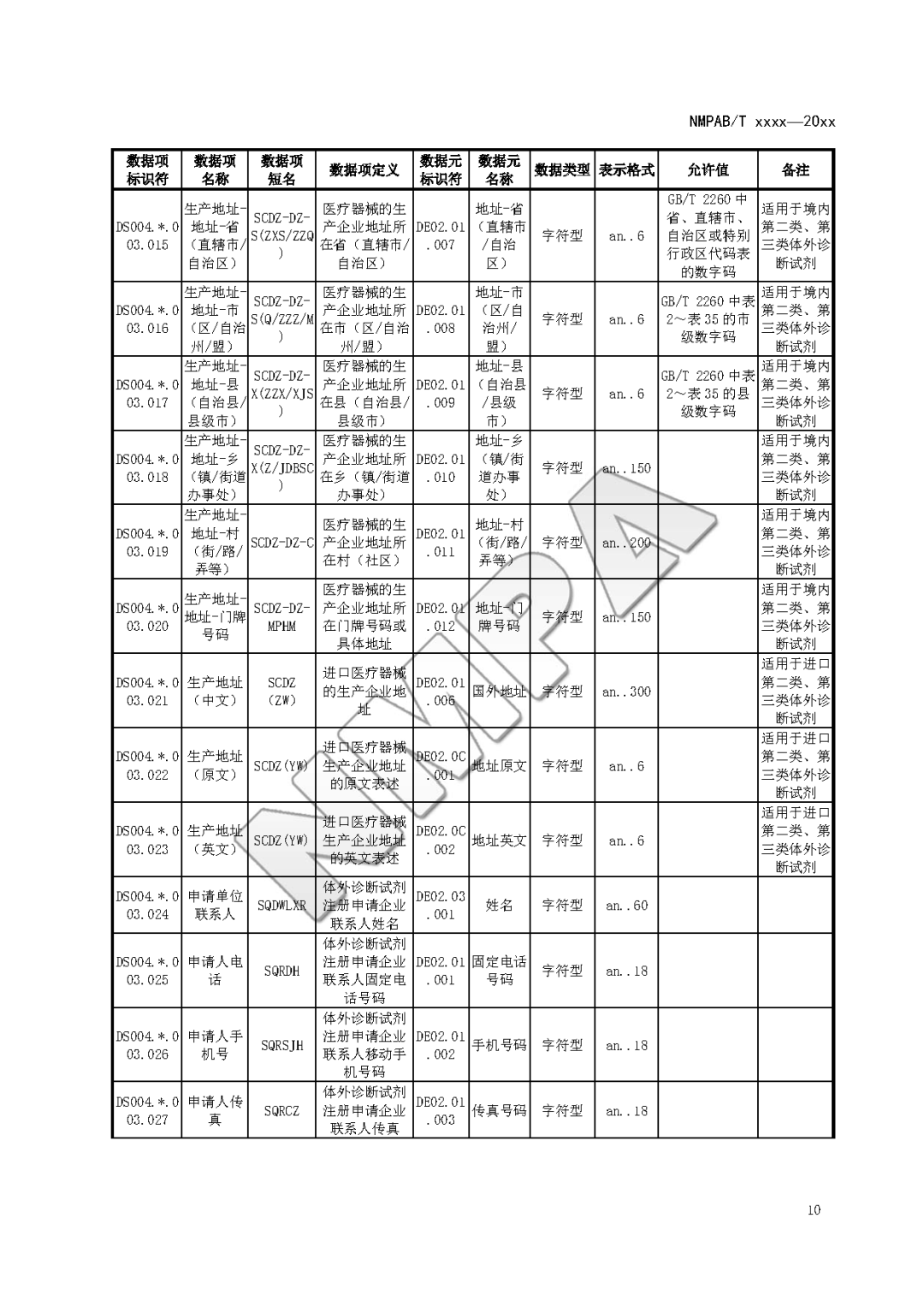
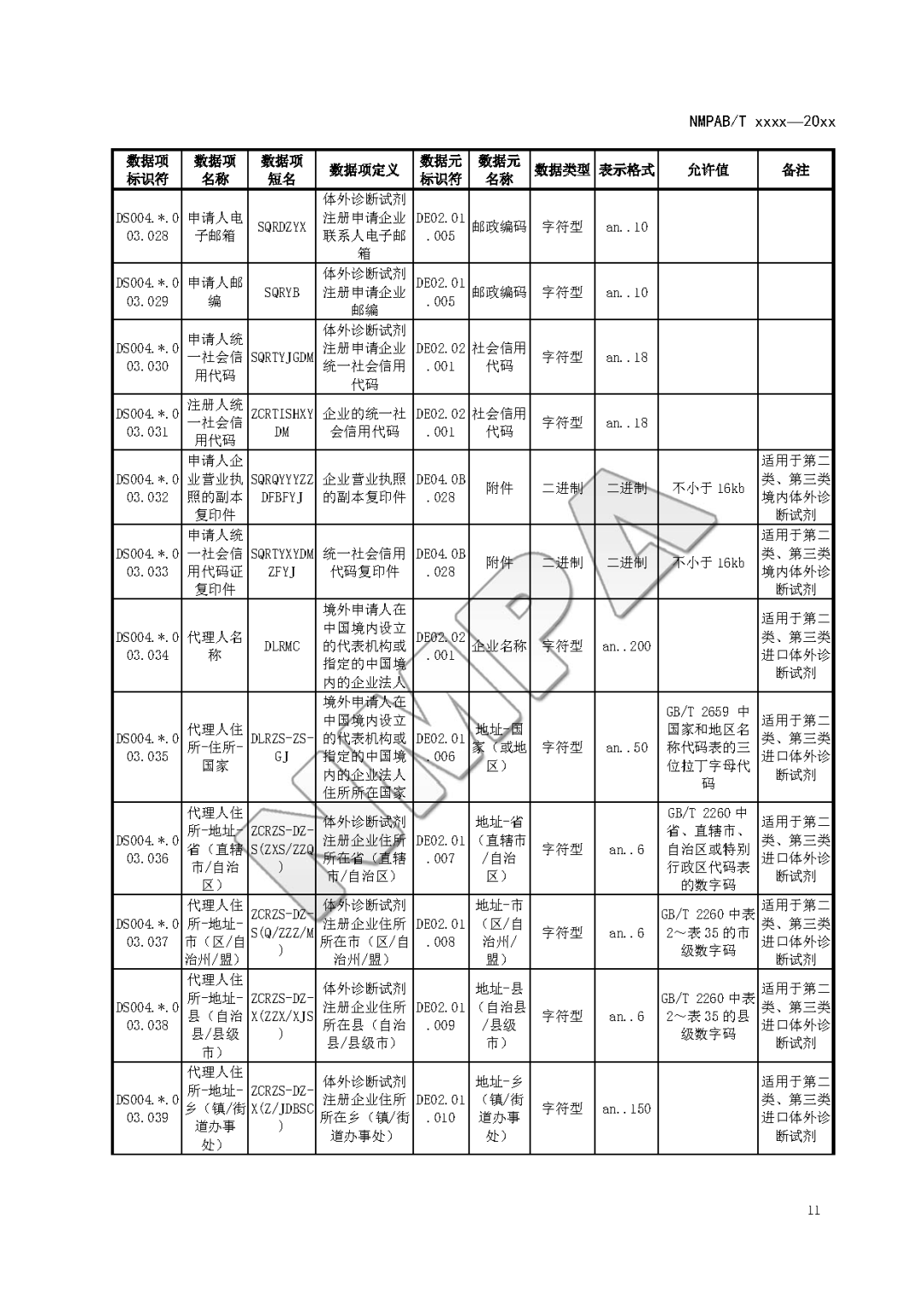
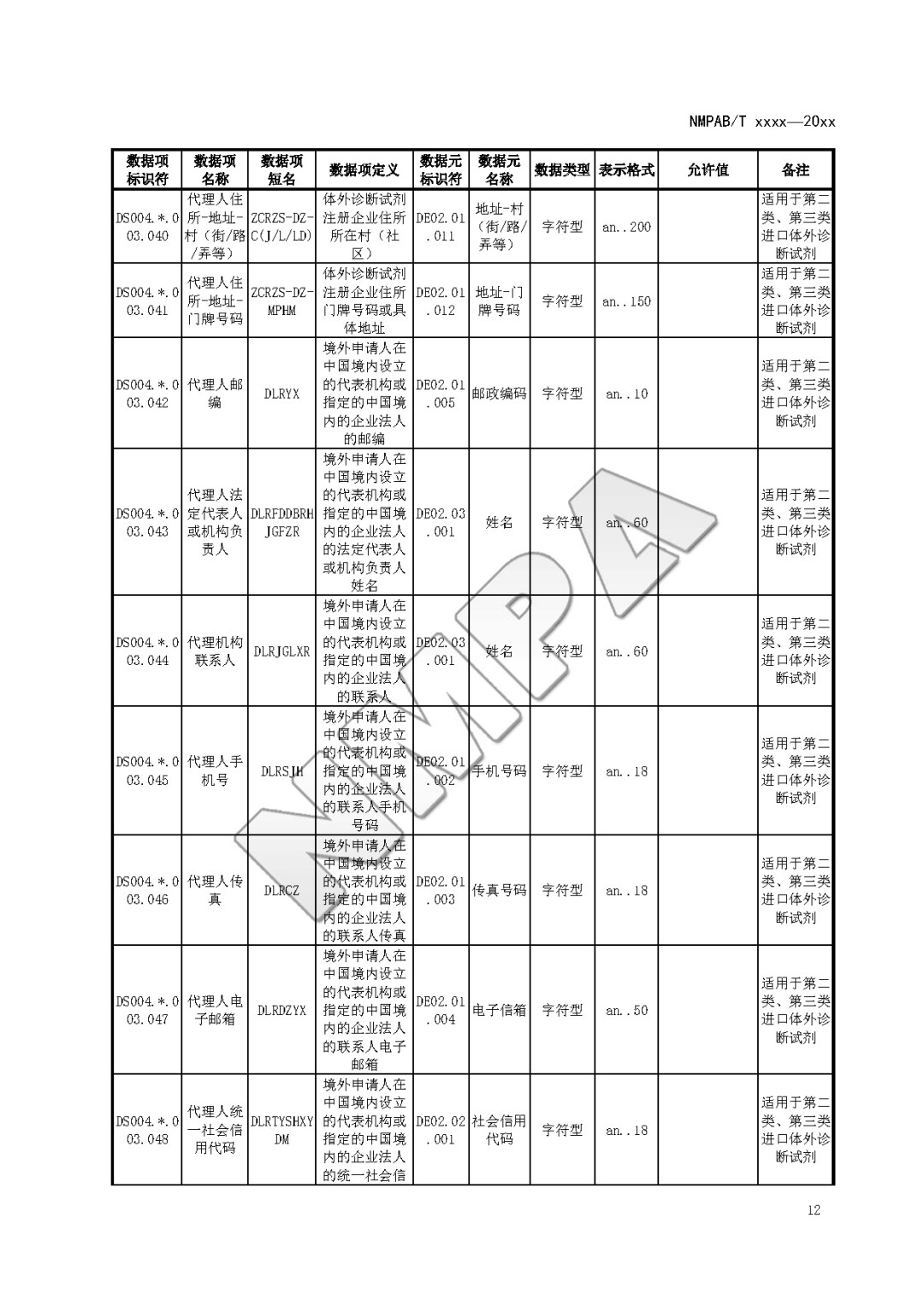
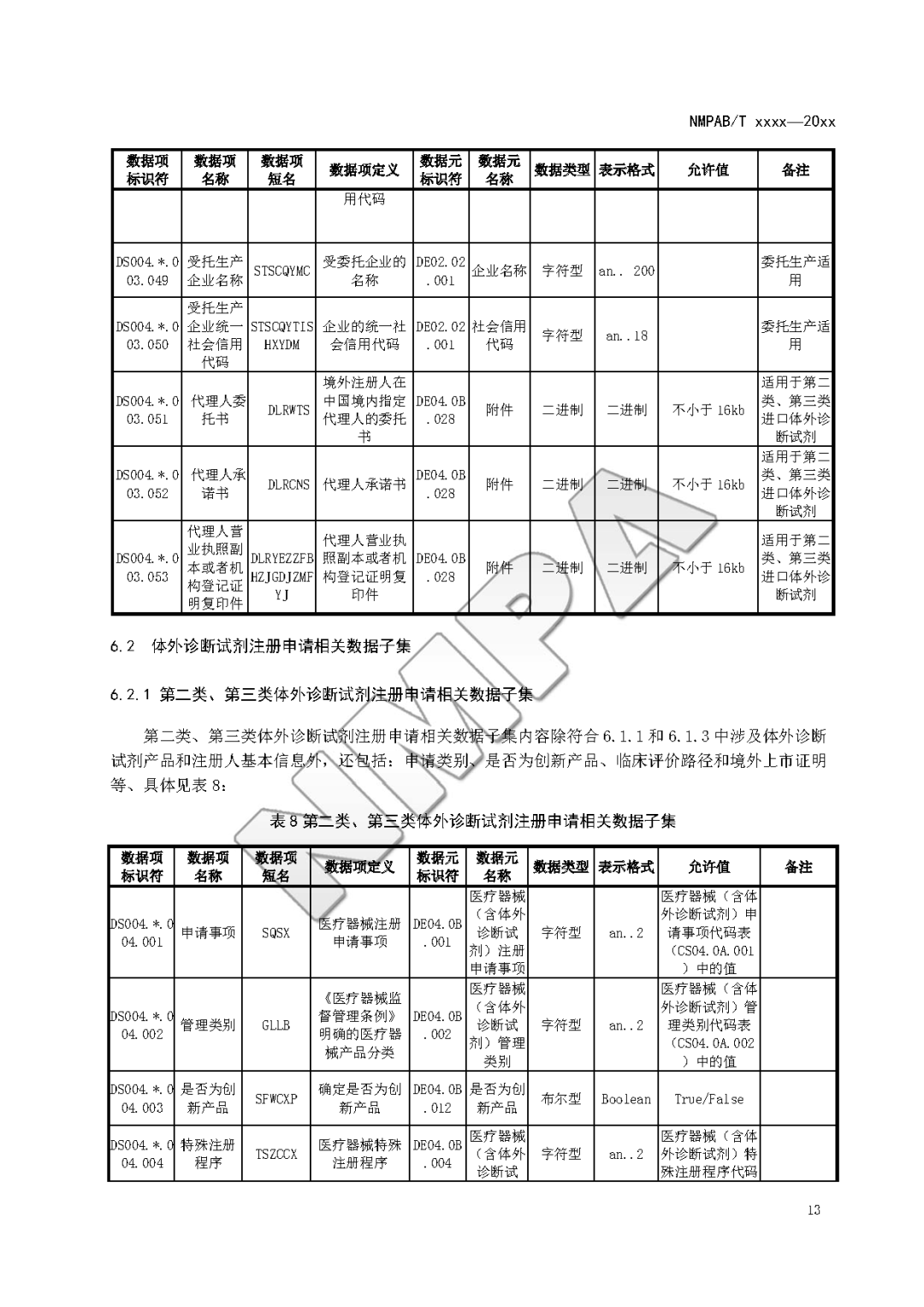
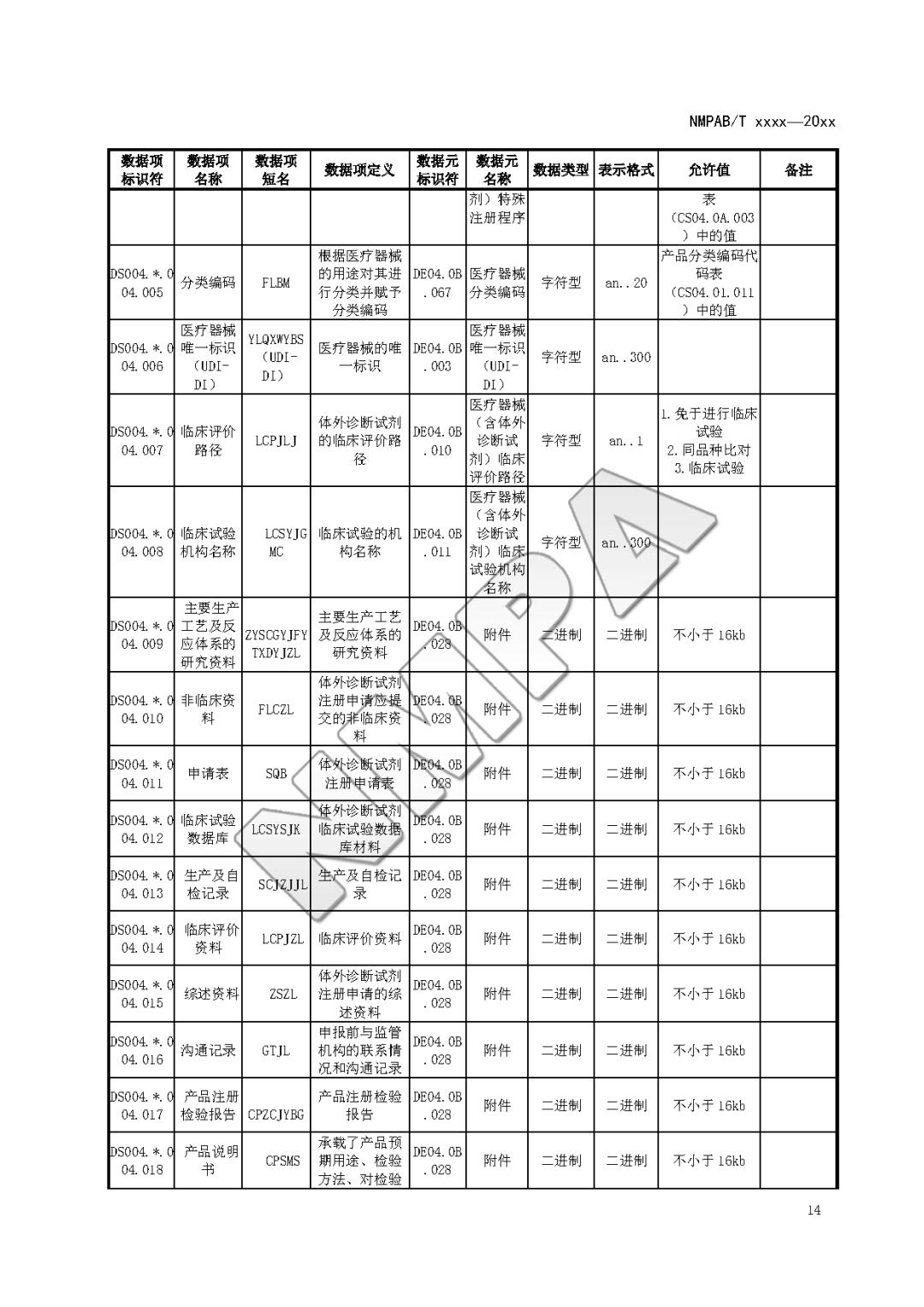
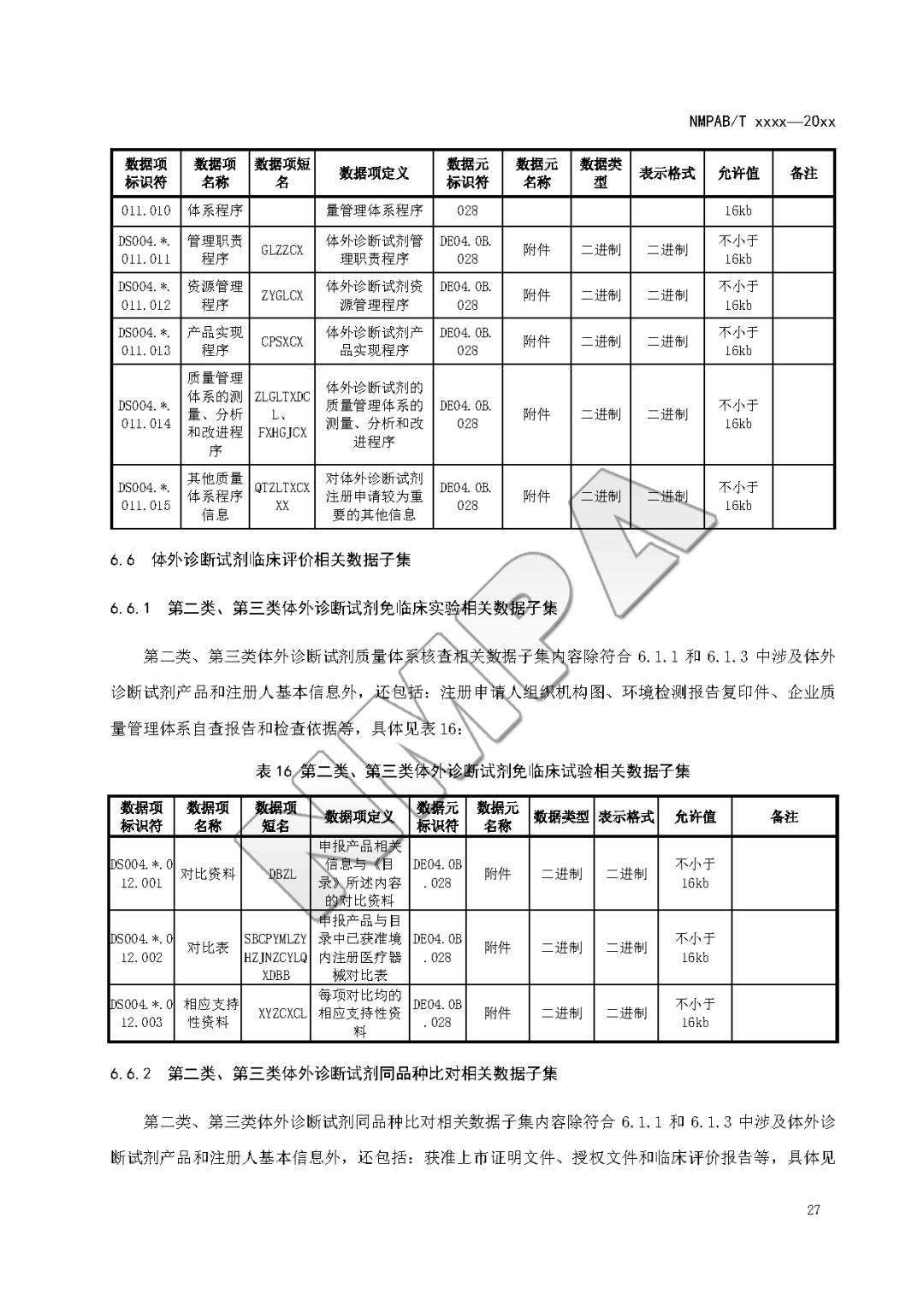
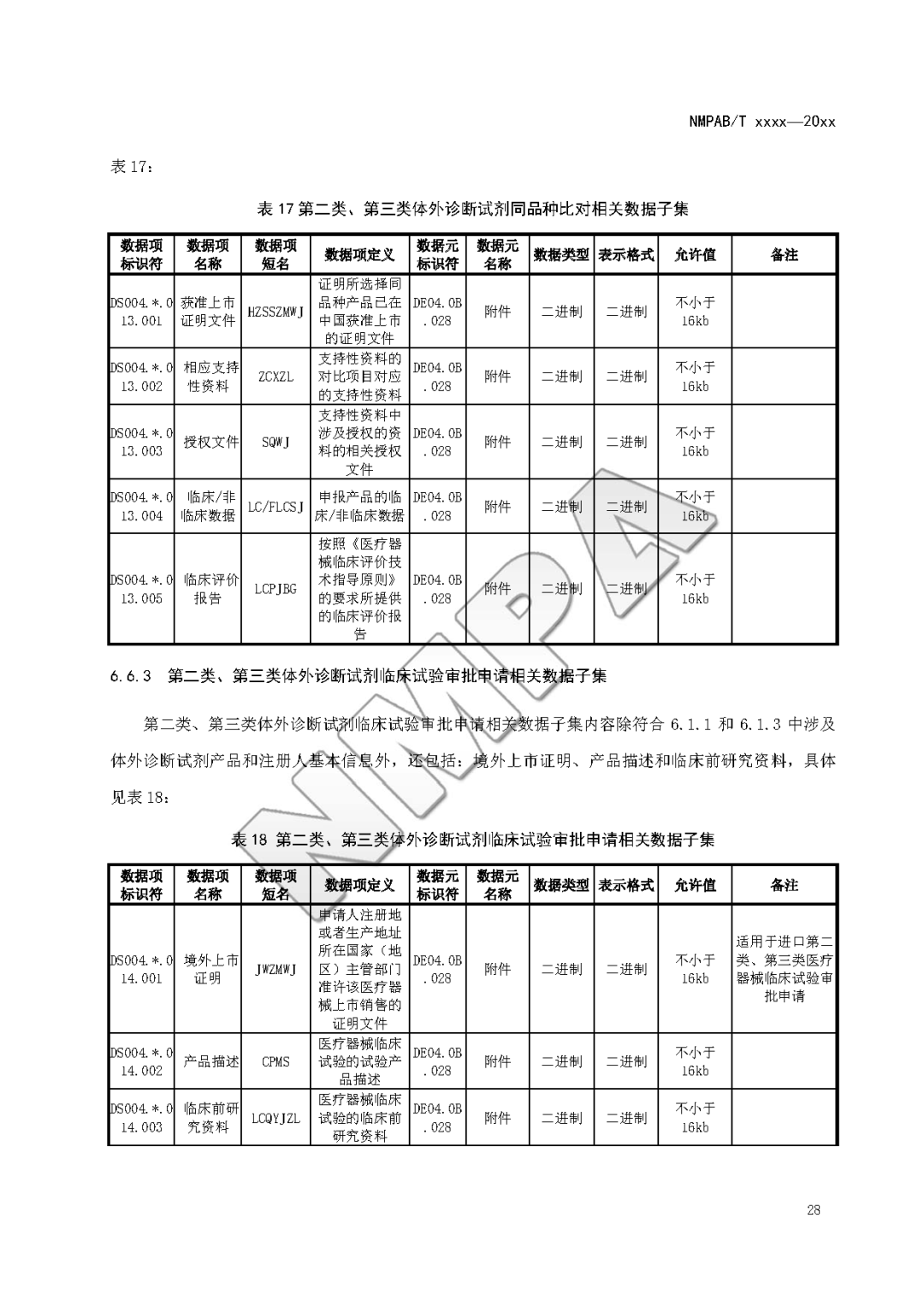
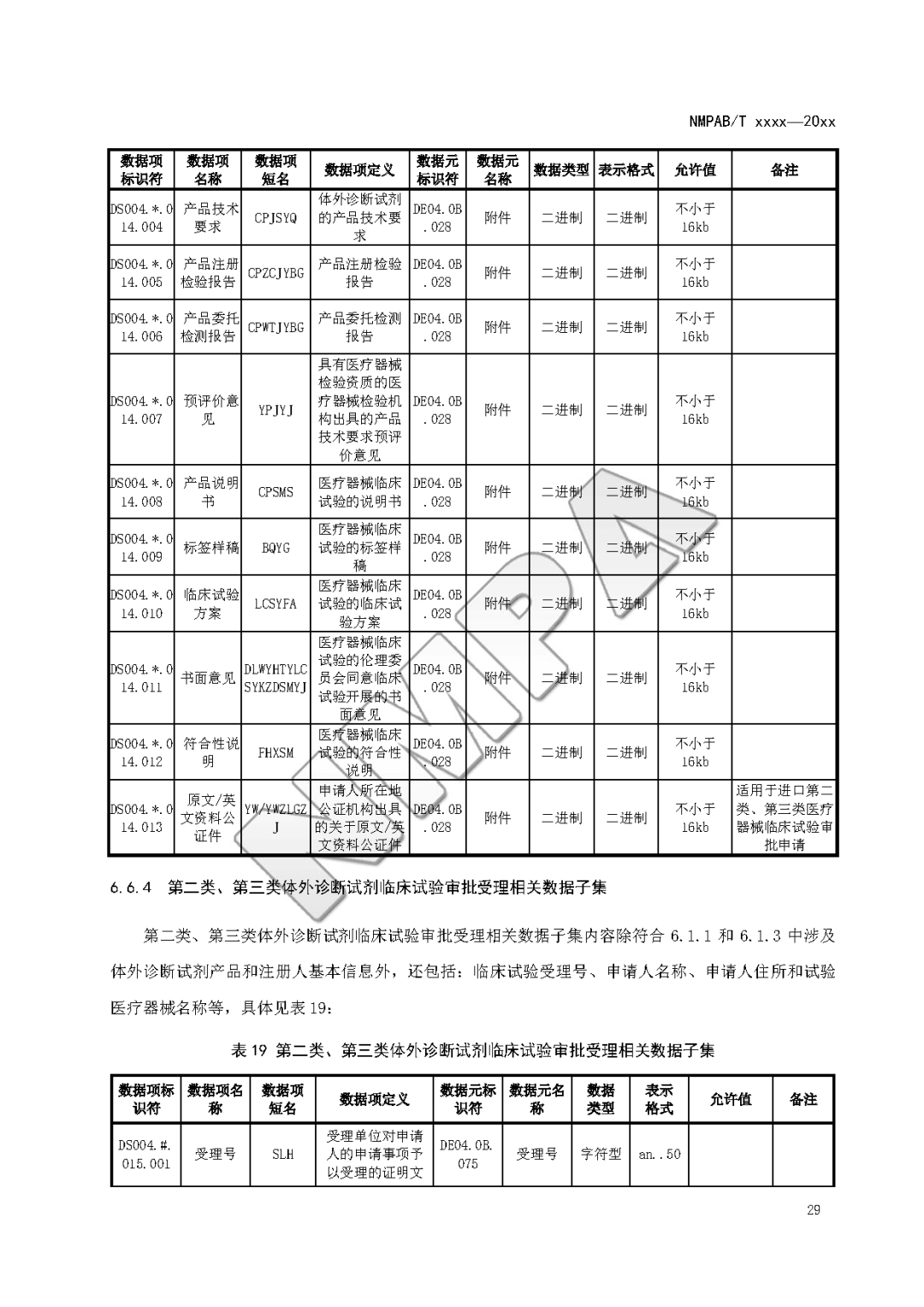
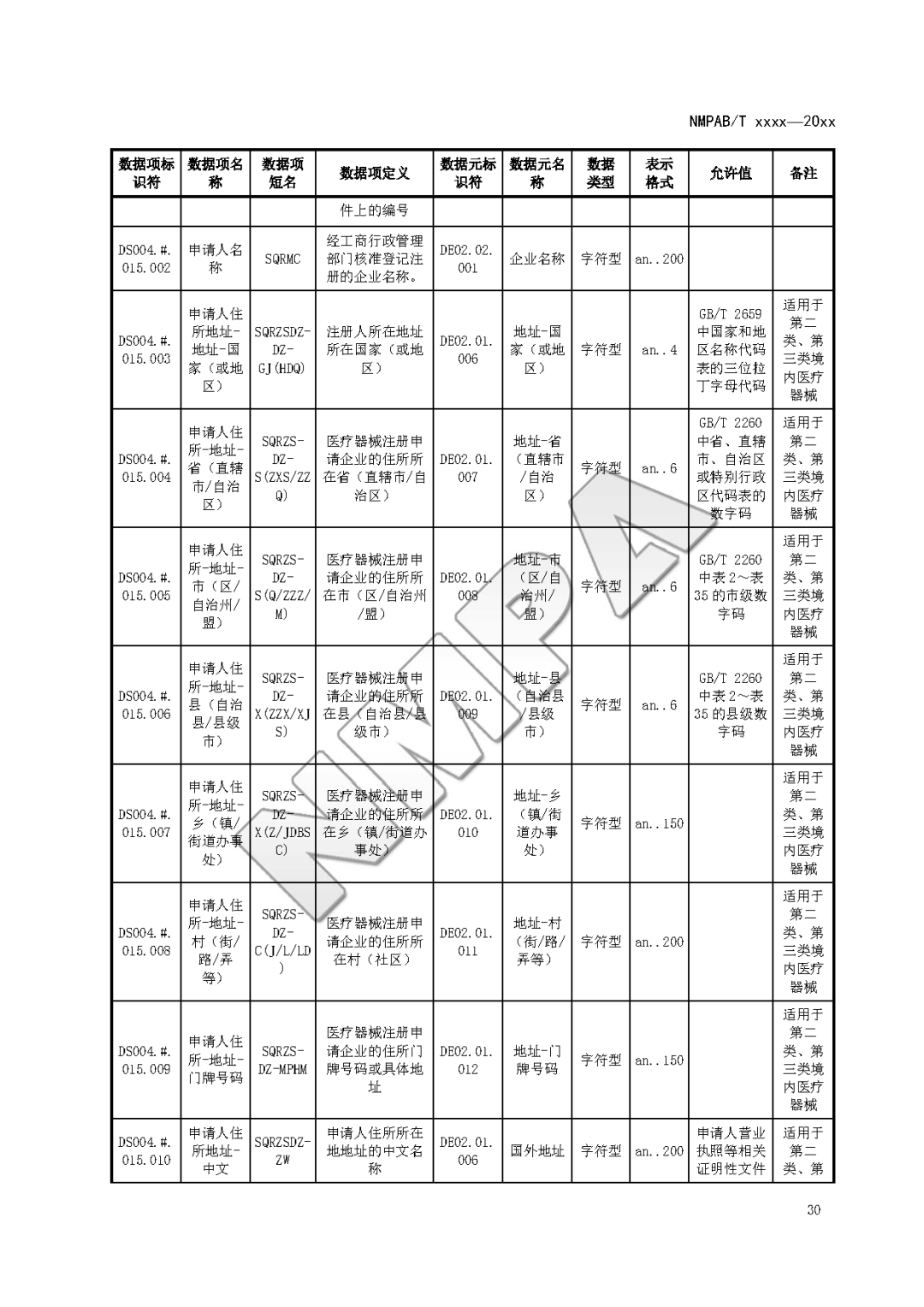
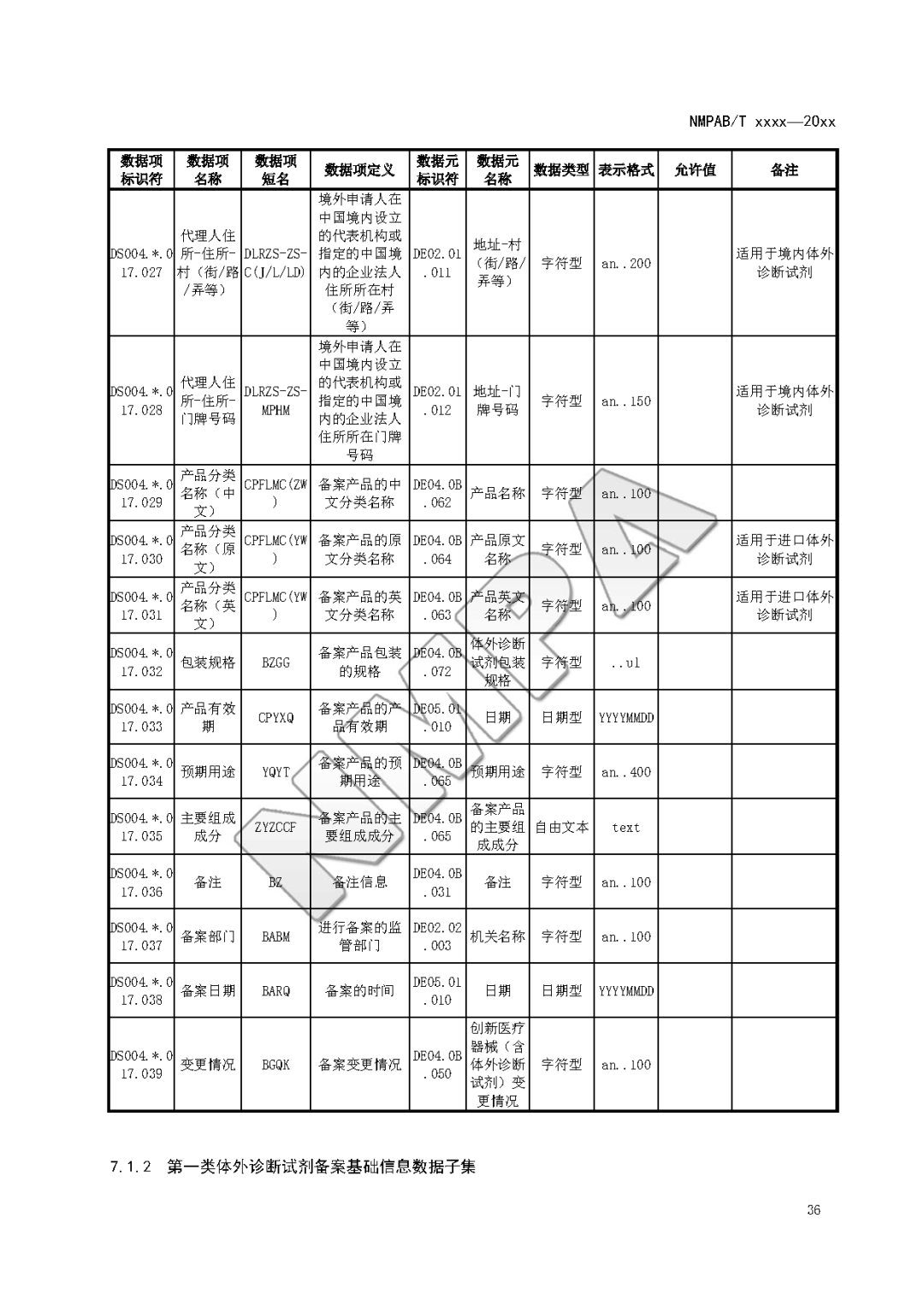
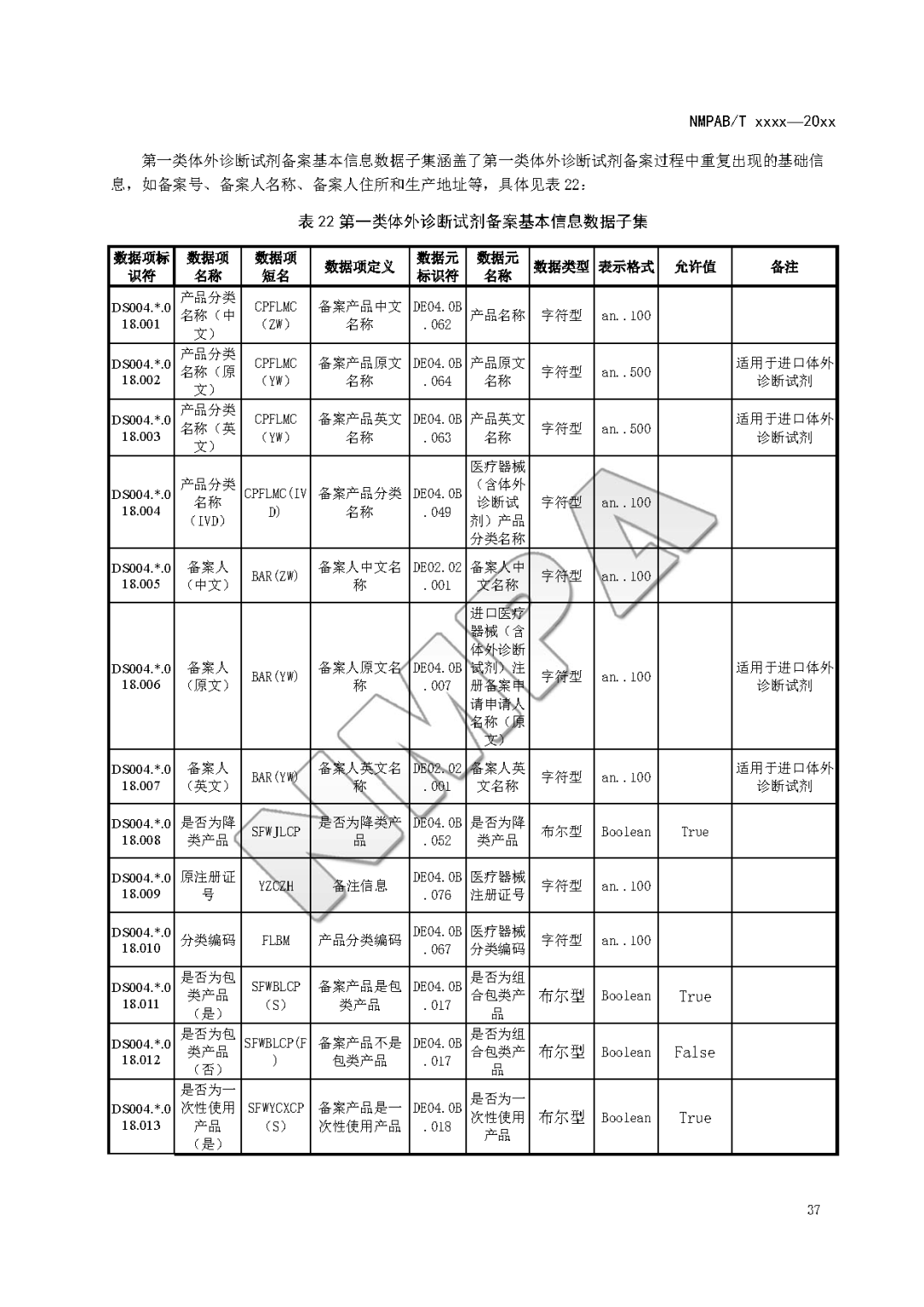
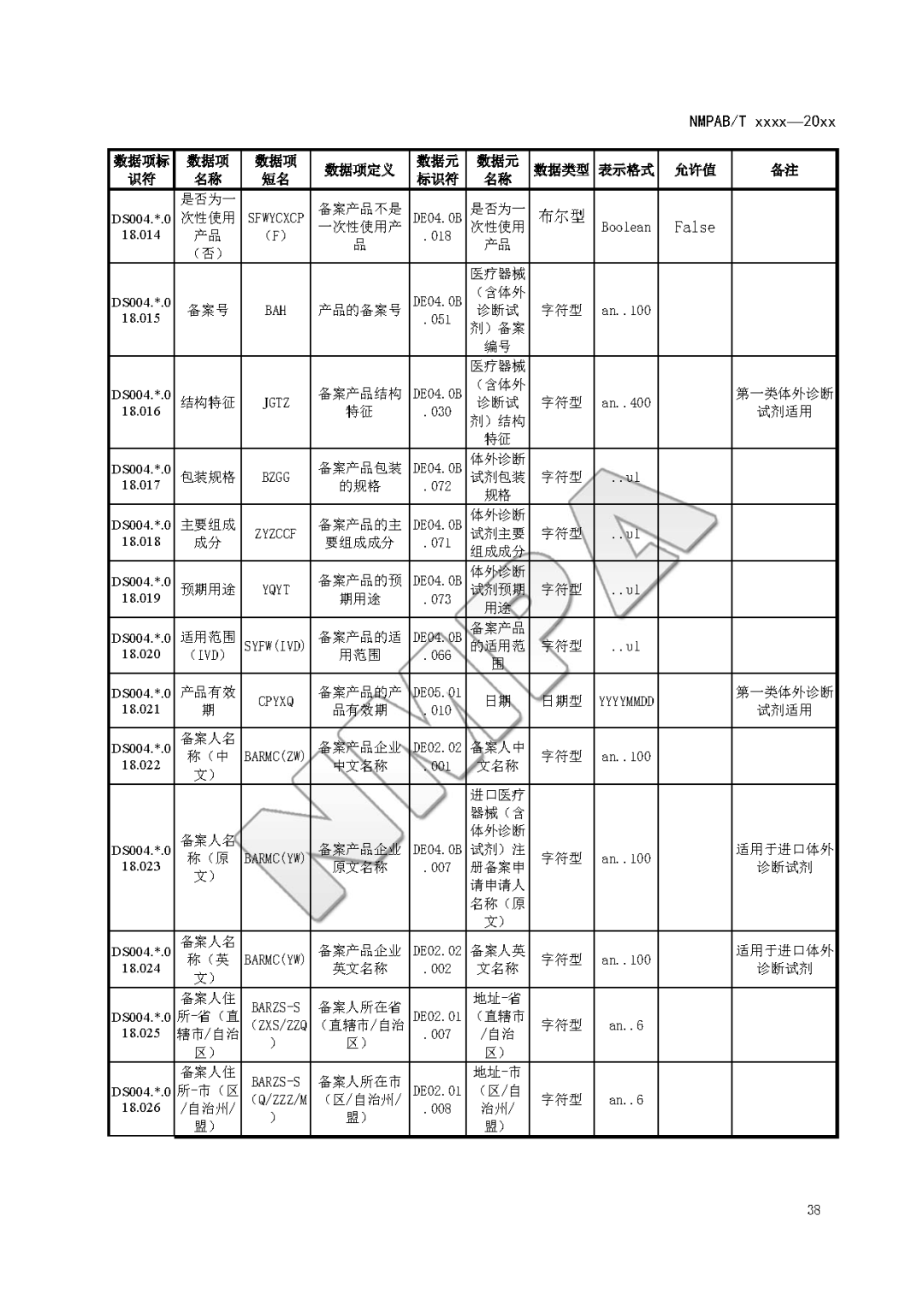
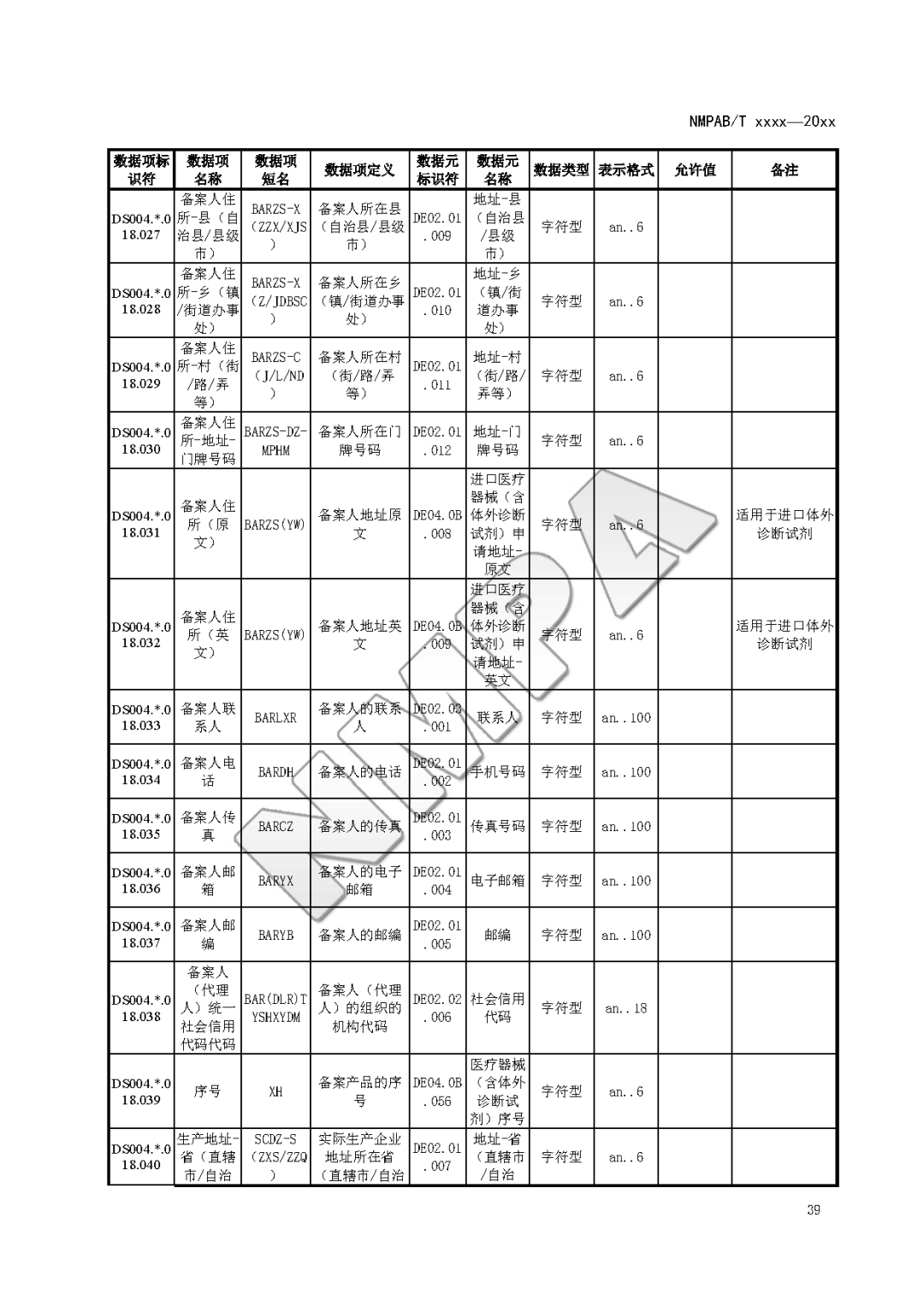
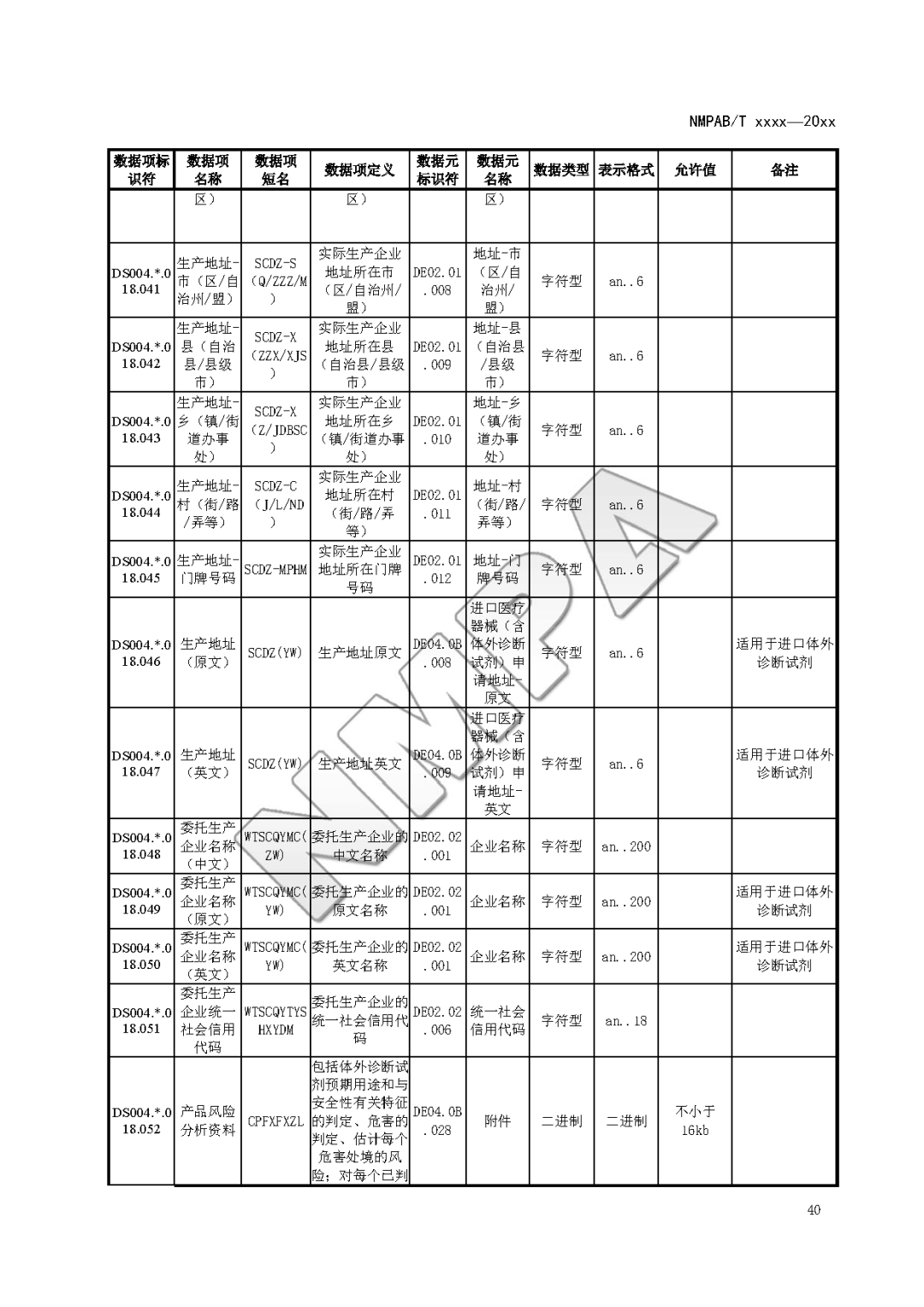
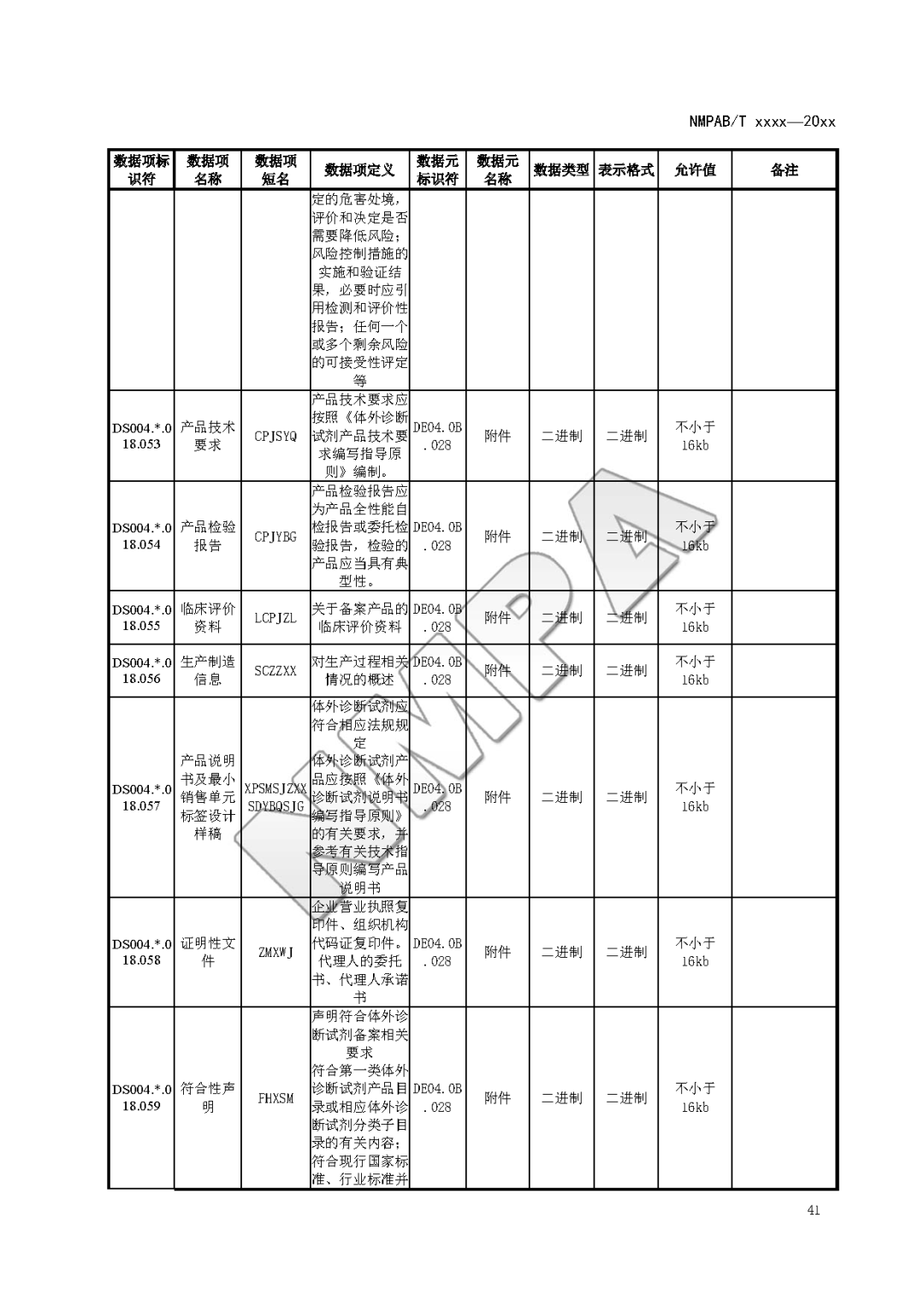
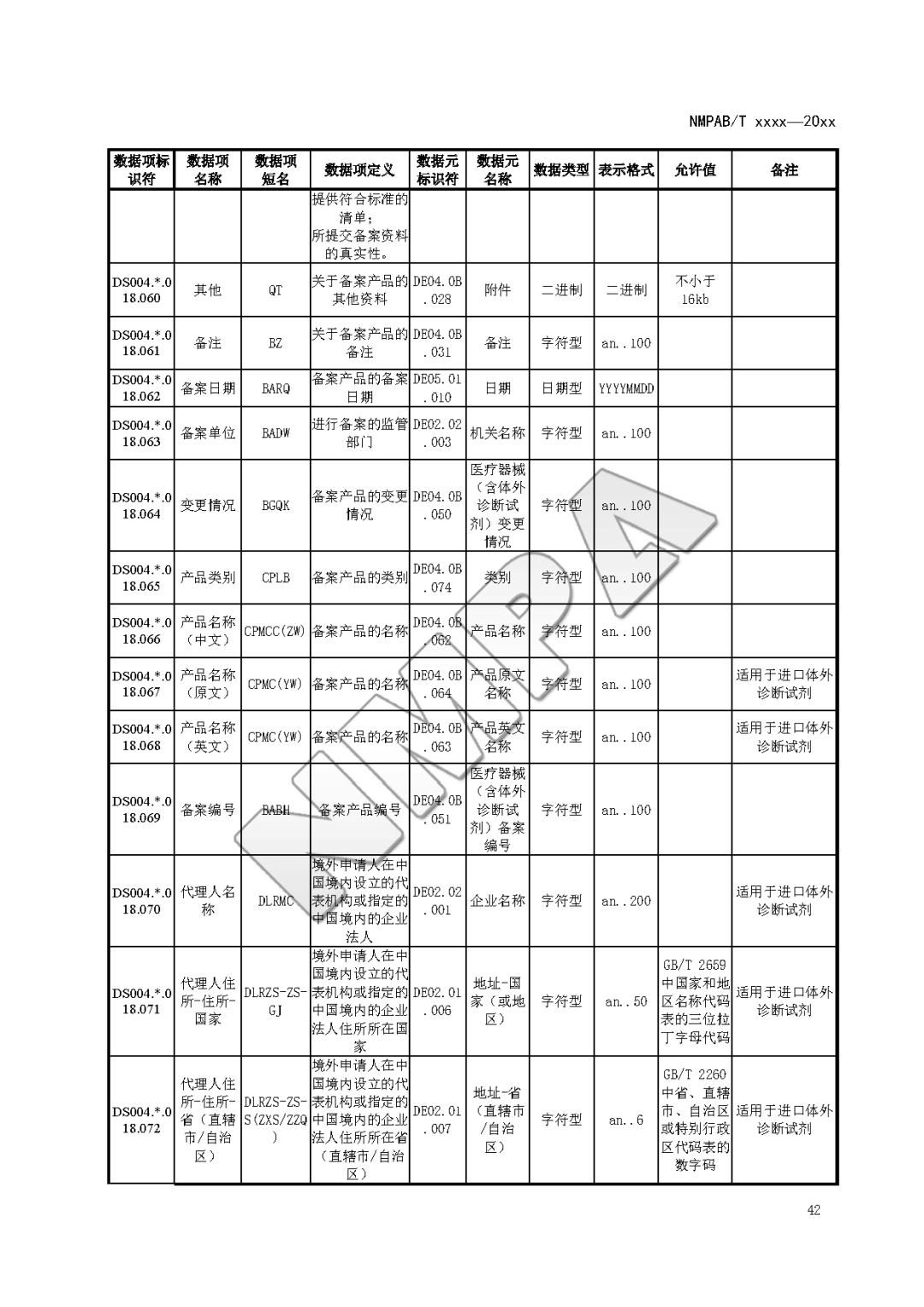
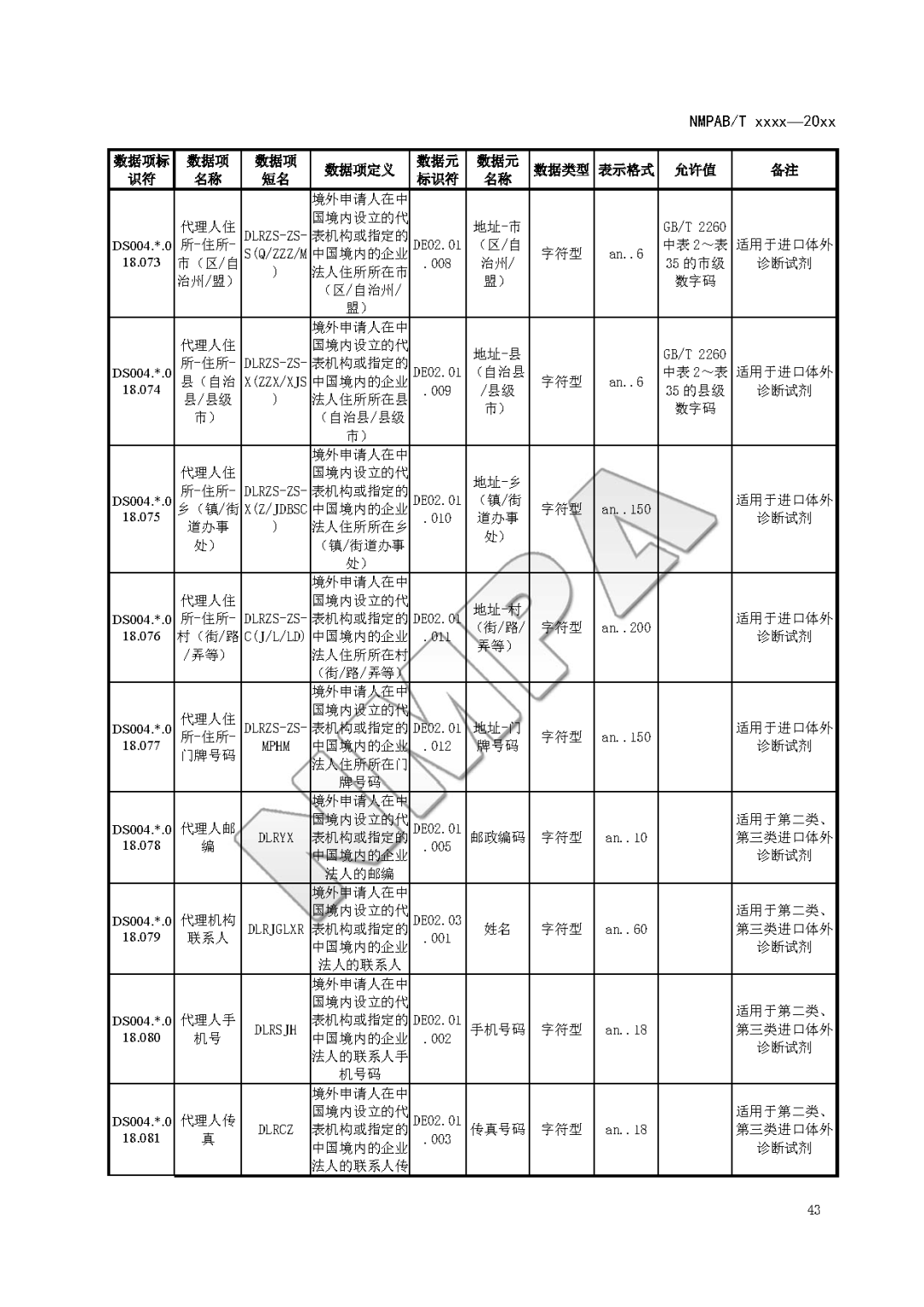
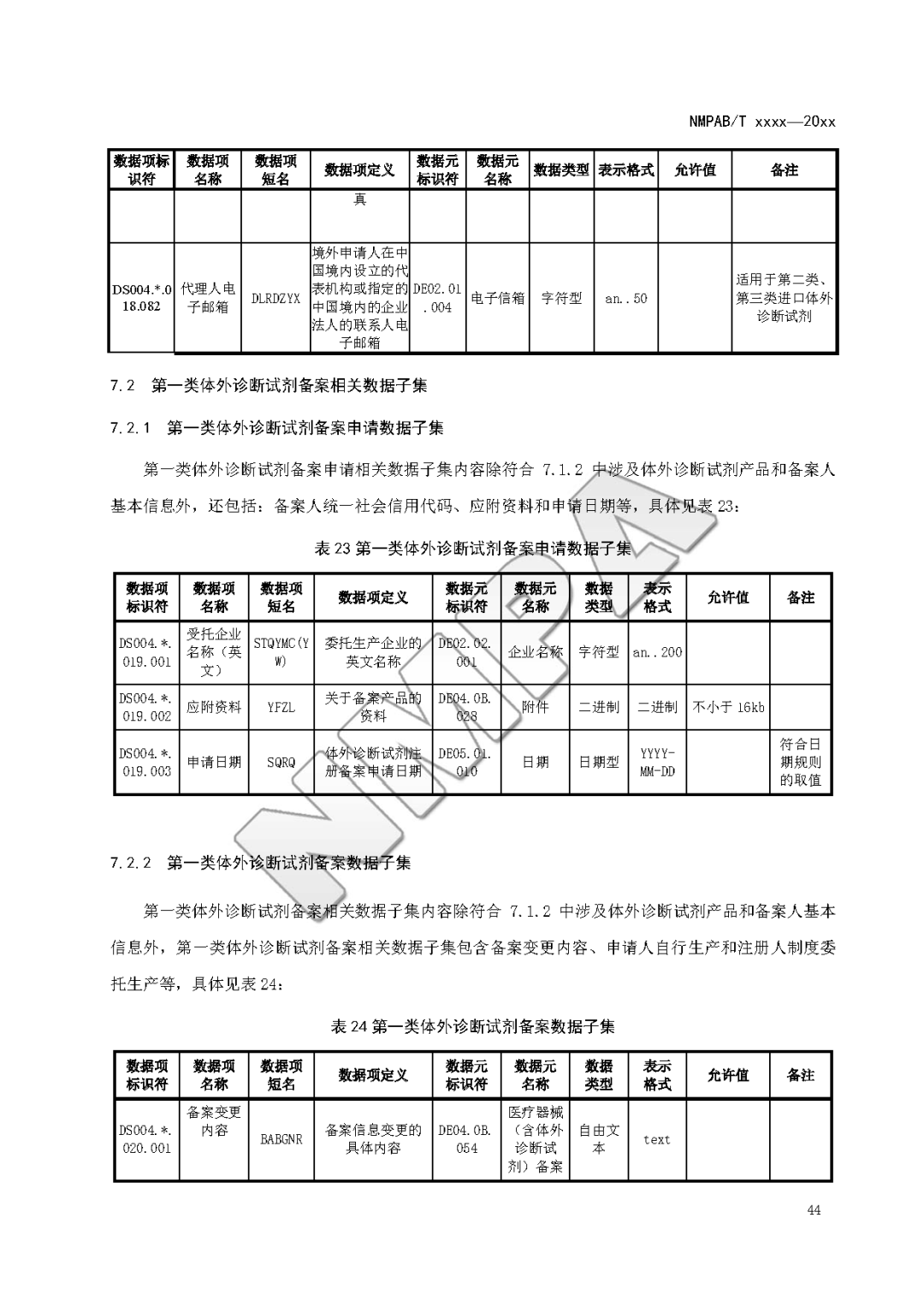
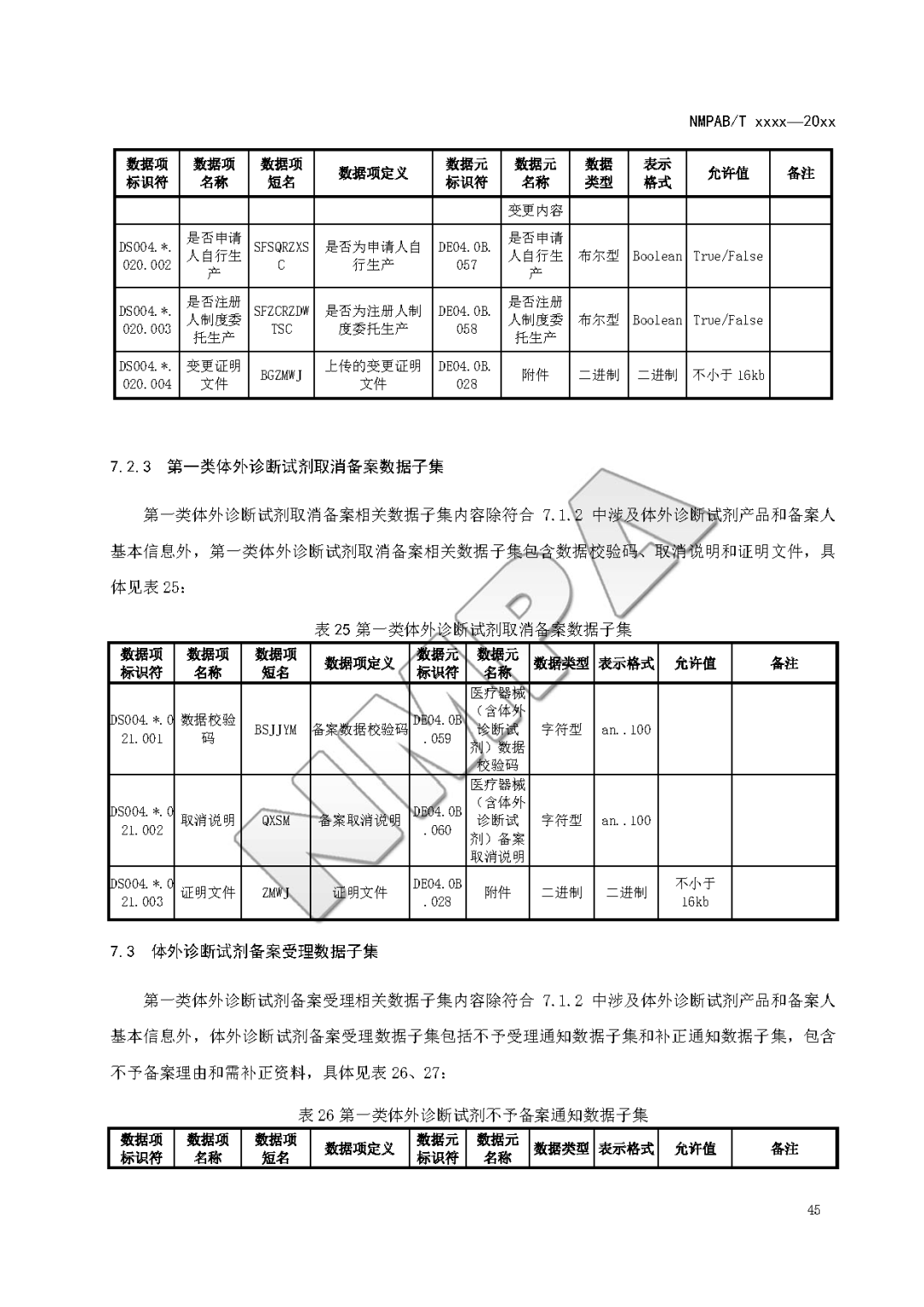
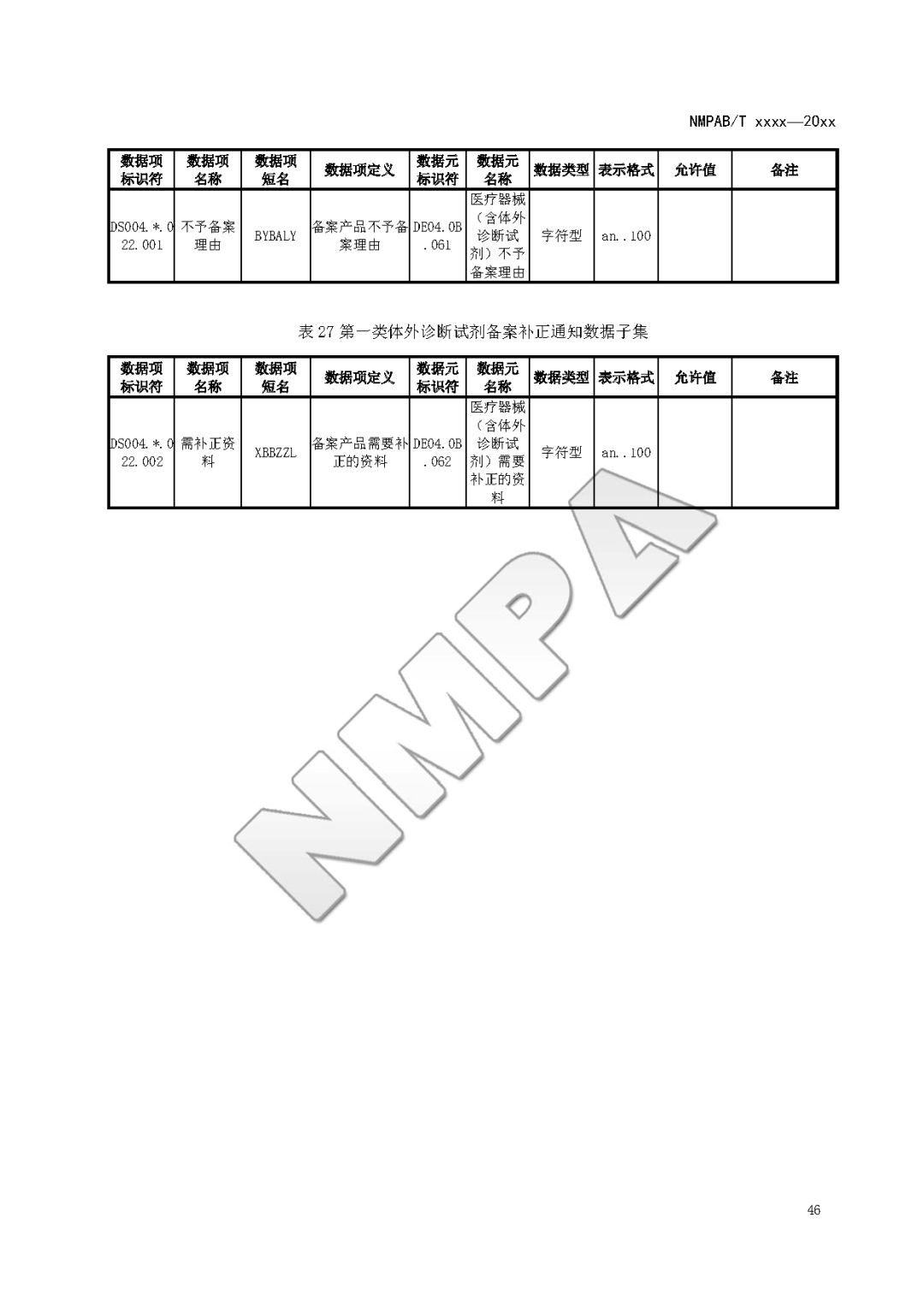
本文为附件2体外诊断试剂注册与备案管理基本数据集(征求意见稿)